Ao navegar neste site, você aceita os cookies que usamos para melhorar sua experiência. Clique aqui para visualizar a Politica de Privacidade e os Termos de Uso.
Átomos: O que são e como eles constroem os elementos?
Data de Publicação: 1 de agosto de 2021 19:02:00 Por: Marcello Franciolle
Todos os elementos da Tabela Periódica são feitos de átomos diferentes, e a estrutura desses átomos resulta em uma gama de fenômenos desde o decaimento radioativo até a energia nuclear
 |
| Os átomos são a base de todos os elementos do universo. Crédito da imagem: KTSDESIGN/SCIENCE PHOTO LIBRARY via Getty Images |
Os átomos são a base dos elementos. Existem 118 elementos conhecidos na Tabela Periódica, 92 dos quais ocorrem naturalmente, e cada um é baseado em um átomo diferente.
A palavra "átomo" vem do grego "atomos", que significa algo que não pode ser cortado, ou que não pode ser dividido. Era uma vez, os primeiros cientistas e filósofos pensaram que esse era realmente o caso, mas acontece que os átomos são construídos a partir de componentes menores e podem de fato ser divididos, liberando grandes quantidades de energia no processo.
Os átomos também são minúsculos. Um átomo típico tem dez bilionésimos de metro de diâmetro. O núcleo de um átomo é apenas um quadrilionésimo (10-15) de um metro.
Então, como a natureza constrói um átomo? A imagem básica é de um núcleo contendo prótons e nêutrons cercados por elétrons que orbitam ao redor do núcleo. Esta descrição está quase correta, por causa do princípio da incerteza na física quântica, não podemos realmente definir uma órbita para um elétron e, em vez disso, eles aglomeram ao redor do núcleo em uma "nuvem" indistinta. Mas para simplificar, a imagem básica servirá por enquanto.
Quanto mais prótons e nêutrons contidos em um núcleo atômico, mais pesado esse elemento é. Assim, por exemplo, o chumbo tem 82 prótons e entre 120 e 132 nêutrons em seu núcleo, enquanto o hidrogênio, o elemento mais leve, tem apenas um próton e ocasionalmente um ou dois nêutrons.
O número de prótons em um átomo de qualquer elemento é sempre o mesmo. Os físicos chamam isso de número atômico. Assim, como no exemplo acima, o chumbo, seu número atômico é 82 e isso não muda; se o fizesse, seria um elemento diferente (tálio, número atômico 81, ou bismuto, número atômico 83). O número de nêutrons no núcleo, como você pode ter percebido no exemplo acima, pode, no entanto, mudar, e chamamos átomos do mesmo elemento com diferentes números de nêutrons "isótopos". Às vezes, esses isótopos são estáveis, mas muitas vezes não são e, eventualmente, decaem.
DESCOBERTA DO ÁTOMO
Sabe-se que os elementos são divididos em unidades básicas de um determinado peso desde o início de 1800, em um insight que veio do cientista inglês John Dalton. Ele considerava essas unidades como partículas fundamentais e indivisíveis, daí seu uso da palavra grega "atomos".
As coisas ficaram mais interessantes em 1897, quando JJ Thomson descobriu elétrons, ao perceber que os raios catódicos eram fluxos de partículas e não ondas eletromagnéticas. Thomson julgou que os elétrons devem vir dos átomos dentro do tubo de raios catódicos que ele estava experimentando. Essa descoberta foi de imensa importância porque significava que os átomos não são as partículas mais fundamentais de todas e que podem ser formados por partículas menores.
No entanto, os átomos são eletricamente neutros, enquanto os elétrons são carregados negativamente. Então Thomson, razoavelmente, pensou que deveria haver algo dentro do átomo com uma carga positiva que estava cancelando as cargas negativas dos elétrons. O que ele imaginou foi chamado de "Modelo de Pudim de Ameixa" com os elétrons embutidos como ameixas no pudim de carga positiva.
As coisas tornaram-se mais definidas em 1913. Experimentos de Ernest Rutherford, juntamente com seus colegas Hans Geiger do famoso contador Geiger e Ernest Marsden, revelou a verdade sobre os átomos. O trio, que estava na Universidade de Manchester, disparou o que na época era chamado de partículas alfa em uma folha de ouro. Se os átomos fossem estruturados de acordo com o modelo do pudim de ameixa, onde continha apenas uma mistura de cargas positivas e negativas, as partículas alfa deveriam simplesmente voar em linha reta. Em vez disso, Rutherford, Geiger e Marsden descobriram que as partículas alfa continuavam sendo desviadas, às vezes por um pequeno ângulo, mas às vezes espalhadas por um grande ângulo, e uma em cada mil ou mais partículas alfa ricocheteavam de volta.
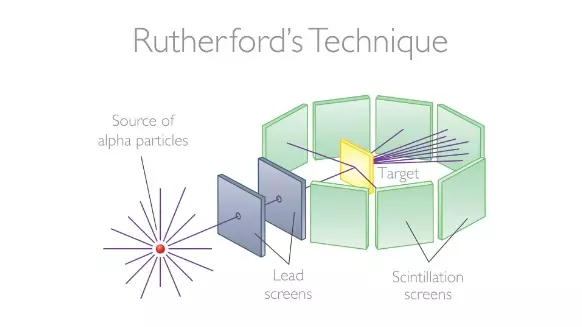 |
| Diagrama do experimento da folha de ouro mostrando partículas alfa sendo desviadas pela folha de ouro. Crédito da imagem: DKN0049 via Getty Images |
Deveria ser impossível para uma partícula alfa retornar diretamente no modelo de pudim de ameixa. Em vez disso, Rutherford, Geiger e Marsden interpretaram seus resultados como significando que havia um núcleo de carga positiva concentrado no centro do átomo, do qual as partículas alfa estavam saltando.
Com base nisso, o físico dinamarquês Niels Bohr, ao lado de Rutherford, desenvolveu um modelo geral do átomo que mostrava os elétrons orbitando o núcleo em camadas correspondentes à sua energia, e que o restante do átomo seria um espaço vazio. São as várias forças que agem através do átomo, a força nuclear forte que liga os nêutrons e prótons, e as forças eletrostáticas das partículas carregadas, que dão a impressão de que os átomos são sólidos.
Além disso, sabemos agora que as partículas alfa são os núcleos do hélio-4, contendo dois prótons e dois nêutrons e, como veremos mais adiante, podem ser o produto do decaimento radioativo.
ELÉTRONS NO ÁTOMO
Como vimos, o número de elétrons girando em torno de um núcleo é geralmente o mesmo que o número atômico, de modo que suas cargas se cancelam resultando em um átomo neutro (os nêutrons também são eletricamente neutros, daí o nome, então eles não contribuem em nada para a carga geral do átomo).
Por mais que imaginemos como os elétrons se movem ao redor do núcleo atômico, seja em órbitas limpas ou como uma "nuvem", sabemos que eles orbitam em camadas de energia cada vez maior, e cada camada pode incorporar até um certo número de elétrons.
A camada de energia mais baixa, que está mais próxima do núcleo, é chamada de camada K e só pode caber dois elétrons. Uma vez que a camada K é preenchida, quaisquer elétrons subsequentes vão primeiro para a camada L, que pode conter 8 elétrons, depois para a camada M, que pode conter 18 elétrons, depois para as camadas N e O, que podem conter 32 elétrons cada. (Na verdade, a camada O poderia teoricamente caber 50 elétrons, mas não há nenhum elemento conhecido com tantos elétrons).
COMO OS ÁTOMOS SE IONIZAM
Os elétrons nem sempre estão confinados às suas camadas específicas. Se um átomo absorve um fóton de luz com energia suficiente, digamos, um fóton ultravioleta de uma estrela quente, essa energia absorvida pode fazer com que um elétron faça a transição para um nível de energia mais alto por um curto período de tempo. Esta é uma situação instável, no entanto, então o elétron cai de volta e, ao fazê-lo, libera a energia absorvida em um comprimento de onda característico daquele átomo em particular.
Às vezes, a energia absorvida pelo átomo quando um fóton o atinge é suficiente não apenas para fazer com que um elétron salte um nível de energia, mas para permitir que o elétron se liberte do átomo. O resultado líquido é que o átomo anteriormente neutro ganha uma carga elétrica porque o número de prótons agora excede o número de elétrons em um (às vezes dois, se dois elétrons forem eliminados). Esse processo é chamado de ionização, e um átomo ionizado é chamado de íon.
Transições de energia de elétrons e ionização são os processos pelos quais as chamadas nebulosas de emissão brilham no espaço. As nebulosas de emissão são frequentemente regiões de formação de estrelas e estão sendo ionizadas pela luz ultravioleta forte das estrelas jovens e massivas nascidas dentro delas.
DECAIMENTO RADIOATIVO
Nem todos os átomos são estáveis. Alguns isótopos são instáveis e decairão espontaneamente. Existem vários tipos de decaimento. Um é o decaimento de partículas alfa, em que um átomo libera um núcleo de hélio. Decaimento beta envolve a emissão de um próton ou um elétron. Em decaimento gama, um fóton de raios gama é emitido.
Esses eventos de decaimento são aleatórios, mas podem ser calculados usando um termo chamado "meia-vida". Isso descreve o tempo que leva para metade da quantidade de qualquer material radioativo decair, em média. Por exemplo, a meia-vida do plutônio-238 é de 87,7 anos, enquanto o urânio-238 tem uma meia-vida de 4,5 bilhões anos.
DIVIDINDO O ÁTOMO
 |
| Dentro de um reator de fusão. Crédito da imagem: Monty Rakusen via Getty Images |
Em retrospectiva, o nome "átomo", referindo-se a algo fundamentalmente indivisível, é bastante impreciso. Os átomos não são apenas formados por partículas menores (prótons e nêutrons, que por sua vez são formados por quarks e elétrons), mas também podem ser divididos. De fato, "dividir o átomo" é uma frase comum que se refere ao poder da fissão nuclear e, assustadoramente, à bomba atômica.
Há muita energia envolvida em um átomo. Bombardeie um átomo com partículas de alta energia suficientes e ele acabará se quebrando, dividindo-se em dois núcleos-filhos de menor número atômico e liberando fótons de energia no processo. Os núcleos-filhos produzidos são diferentes para cada evento de fissão. Os reatores nucleares bombardeiam átomos de urânio-235 ou plutônio-239 com nêutrons e, à medida que os átomos se dividem, produzem energia e mais nêutrons, que podem então dividir outros átomos de urânio e plutônio em uma reação em cadeia. O urânio-238 também é fissionável, mas são necessários nêutrons "rápidos" em energias mais altas para dividi-lo. Este é frequentemente o processo usado em armas nucleares.
A fissão nuclear resulta em resíduos nucleares radioativos na forma de isótopos filhos produzidos pela divisão do urânio ou plutônio, que muitas vezes se decompõem com meias-vidas de escalas de tempo muito longas e, portanto, o descarte desses resíduos é um problema ambiental que ainda não foi suficientemente resolvido.
Uma alternativa à fissão nuclear é a fusão nuclear. Como o nome sugere, isso envolve a fusão de dois átomos para criar um átomo mais pesado, liberando energia no processo. Existem várias vantagens, incluindo a produção de mais energia, a não dependência de elementos radioativos, como o plutônio, que precisam de manuseio cuidadoso, e o fato de que a fusão não produz resíduos radioativos. Em vez disso, elementos leves podem ser usados, como deutério (um isótopo de hidrogênio que tem um próton e um nêutron) e trítio (um isótopo de hidrogênio contendo um próton e dois nêutrons), e são de fato preferidos. Isso ocorre porque, para fundir dois átomos, a força de Coulomb deve ser superada.
A força de Coulomb é a força eletrostática sentida por cargas semelhantes, as cargas positivas dos prótons em um núcleo atômico repelirão as cargas positivas dos prótons no outro núcleo atômico ao tentar fundi-los. No entanto, com energia suficiente, isso pode ser superado e, como os núcleos com um número atômico menor têm menos prótons, a força de Coulomb é mais fraca e requer menos energia para ultrapassar. Gerar essa energia envolve criar altas temperaturas e pressões. A fusão termonuclear cria um plasma quente, um estado da matéria formado por íons e elétrons em vez dos átomos eletricamente neutros encontrados no gás, que pode ser confinado, por exemplo, por campos magnéticos em um dispositivo chamado tokamak, e a pressão no plasma se torna tão grande que os núcleos começam a se fundir. Outro método é a fusão de confinamento inercial, em que grânulos de deutério e trítio são aquecidos e comprimidos, muitas vezes por feixes de laser muito poderosos.
Embora os físicos tenham alcançado a fusão nuclear controlada, os experimentos atuais ainda precisam colocar mais energia nas reações de fusão do que a quantidade de energia que as reações estão produzindo. No entanto, há esperança de que outras experiências, como no ITER, o Reator Internacional de Experimentos Termonucleares perto de Marselha, na França, aperfeiçoará as técnicas para viabilizar a geração de energia por fusão em larga escala até a segunda metade deste século.
Infelizmente, reações termonucleares descontroladas são, no entanto, mais fáceis de gerar. Estes são utilizados em armas termonucleares. Mas felizmente, reações de fusão descontroladas também são o que mantém o sol e todas as estrelas brilhando, no núcleo de uma estrela, a pressão da contração gravitacional aumenta a temperatura e a pressão o suficiente para fundir elementos desde o hidrogênio até o ferro, em um processo conhecido como nucleossíntese estelar. Explosões de supernovas são ainda mais energéticas e podem fundir elementos mais pesados que o ferro.
RECURSOS ADICIONAIS
- Leia sobre os diferentes tipos de radiação com mais detalhes com esses recursos dos Centros de Controle e Prevenção de Doenças.
- Uma história detalhada das partículas alfa e do trabalho de Rutherford sobre o átomo pode ser encontrada no site do American Institutes of Physics.
- Explore os átomos com ainda mais detalhes com o Instituto de Física.
- Se você quiser aprender mais sobre nucleossíntese estelar, a Universidade de Oxford tem mais informações em seu site de filosofia da cosmologia.
BIBLIOGRAFIA
- Física de Partículas, por Brian R. Martin (2011, Publicações One-World)
- Os Elementos: Uma Exploração Visual de Cada Átomo Conhecido no Universo, por Theodore Gray (2009, Black Dog e Leventhal Publishers)
- The Cambridge Encyclopedia Stars, por James B. Kaler (2006, Cambridge University Press)
♦ Todos os artigos baseados em tópicos são determinados por verificadores de fatos como corretos e relevantes no momento da publicação. Texto e imagens podem ser alterados, removidos ou adicionados como uma decisão editorial para manter as informações atualizadas.
—Este artigo foi atualizado em 31 de outubro de 2022 pelo editor da Gaia Ciência.
Junte-se aos nossos Canais Espaciais para continuar falando sobre o espaço nas últimas missões, céu noturno e muito mais! Siga-nos no facebook, twitter e instagram. Inscreva-se no boletim informativo. E se você tiver uma dica, correção ou comentário, informe-nos aqui ou pelo e-mail: gaiaciencia@gaiaciencia.com.br
Referência:
DINNER, Josh. Atoms: What are they and how do they build the elements? Space, Nova York, 30, out. 2022. References. Disponível em: <https://www.space.com/atoms-definition-history-facts>. Acesso em: 31, out. 2022.
 |
Marcello Franciolle F T I P E
Founder - Gaia Ciência
Marcello é fundador da Gaia Ciência, que é um periódico científico que foi pensado para ser uma ferramenta para entender o universo e o mundo em que vivemos, com temas candentes e fascinantes sobre o Universo e Ciências da Terra para inspirar e encantar as pessoas. Ele é graduando em Administração pelo Centro Universitário N. Sra. do Patrocínio (CEUNSP) – frequentou a Universidade de Sorocaba (UNISO); graduação em Análise de Sistemas e onde participou do Encontro de Pesquisadores e Iniciação Científica (EPIC). Suas paixões são literatura, filosofia, poesia e claro ciência.
Seja o primeiro a comentar!
Os comentários são de responsabilidade exclusiva de seus autores e não representam a opinião deste site. Envie seu comentário preenchendo os campos abaixo
|
Nome
|
E-mail
|
|
Localização
|
|
|
Comentário
|
|